北京2024年11月8日 /美通社/ -- 今日,波士顿科学在第35届长城心脏病学大会上,为旗下FARAPULSE™系列脉冲电场消融(PFA)产品(以下简称"FARAPULSE系列产品")举行了上市启动仪式。今年1月,FARAPULSE系列产品在获得美国FDA批准后,相隔不到半年便获得国家药品监督管理局(NMPA)批准,自9月中旬起,该产品陆续在国内开启临床使用,目前全国已有多家电生理中心开展了FARAPULSE脉冲电场房颤消融手术。

波士顿科学于第35届长城心脏病学大会举办FARAPULSE脉冲消融新技术午间会
房颤是最常见的快速性心律失常之一,若患者得不到有效治疗,可能显著增加卒中和心力衰竭等风险,甚至导致死亡。大规模流行病学调查显示,我国约有1200万房颤患者[1]。随着国内人口老龄化持续加深,预计未来患者数量会进一步增加。当前,导管消融逐渐成为房颤节律控制的一线治疗手段[1],不同于传统热能消融,全新的脉冲电场消融(PFA)技术以其安全性、有效性等独特优势,正在全球范围内成为导管消融领域技术革新的前沿趋势。作为全球被研究和使用最多的PFA产品,FARAPULSE系列产品迄今在全球范围内治疗超过125,000例患者,是目前临床循证医学证据最多的PFA技术。
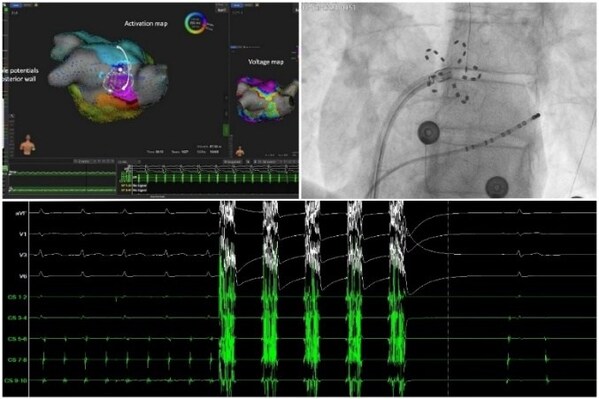
上市会现场,多位国内电生理专家分享了他们在临床使用FARAPULSE系列产品的经验,对手术操作的安全性、有效性和高效性进行了反馈。其中,多位专家表示FARAPULSE引领的脉冲电场消融开启了房颤消融治疗新的时代,脉冲电场能量的"组织选择性"降低了消融时邻近组织的损伤风险。历经十年研发优化的导管设计,能量输出和标准放电流程,FARAPULSE经过大量研究验证,能够兼顾消融的有效性和减少副反应,使得医生手术过程中更加安心,进一步降低房颤消融的并发症。在MANIFEST-17K注册登记研究中,超过17,000名患者的真实数据未出现永久性膈神经麻痹、肺静脉狭窄或食管损伤的报告[2],充分体现了使用FARAPULSE系列产品进行手术的安全性。
参会专家也在会议中分别探讨了FARAPULSE在临床使用过程中的有效性反馈,多位专家表示经过标准的32次放电流程后,即刻肺静脉隔离率非常好。一系列临床研究也印证了使用FARAPULSE系列产品的有效性:手术中肺静脉即刻隔离率达到100%[3],3个月肺静脉复标测隔离率为96%[4],一年阵发房颤手术成功率为90%[5]。
此外,FARAPULSE的手术简单快速,部分医生表示肺静脉消融时间甚至可以控制在10分钟以内,手术时间大幅缩短,让临床医生在手术过程中不必全程处于高度紧张状态,同时可以提升导管室轮转效率。脉冲电场消融新技术开启了房颤消融新能量时代,手术消融流程还需要进一步优化探索,专家们也非常期待未来结合三维系统的FARAPULSE。
在启动仪式上,波士顿科学也带来了PFA产品组合中的最新进展:今年10月,带有磁定位标测功能的FARAWAVE NAV 心脏脉冲电场消融(PFA)导管*获美国FDA批准,新的FARAVIEW软件模块*也获得了FDA 510(k)许可。这两款产品与波士顿科学现有的心脏标测技术以及公司最新推出的OPAL HDx标测系统*完全兼容,将为心脏消融手术提供可视化支持。
波士顿科学大中华区总裁张珺表示:"波士顿科学致力于将源于医患真实需求的新想法,转化为突破性服务和可持续解决方案。很高兴看到FARAPULSE系列产品目前已经开始为广大国内患者带来创新临床价值,也收获了从行业到医患的积极反馈,让我们看到这款产品造福更多患者的巨大潜力。期待未来这款产品后续的迭代升级能早日落地中国,继续为中国电生理医生和患者带来更安心、更高效、更有效的房颤手术体验,为助力中国降低房颤疾病负担贡献力量。"
*该产品尚未在中国内地上市
注意:法律规定这些器械由医生或按医生的指令销售。适用范围、禁忌内容、警告和使用说明可在产品标签或说明书中找到。产品仅供参考,在某些国家尚未被批准销售。
产品名称:FARASTAR 心脏脉冲电场消融系统 注册证号:国械注进20243010354
产品名称:FARAWAVE一次性使用心脏脉冲电场消融导管 注册证号:国械注进20243010355
产品名称:FARADRIVE Steerable Sheath一次性使用可调弯导管鞘 注册证号:国械注进20243030396
注册人/生产企业名称: 法拉普尔赛股份有限公司 FARAPULSE, Inc.
PSST-CN-202411-0002/ Version A/ 生效日期2024 年11月5 日,失效日期2025年11 月5 日
© 2024年由波科或其子公司制作。保留所有权利。